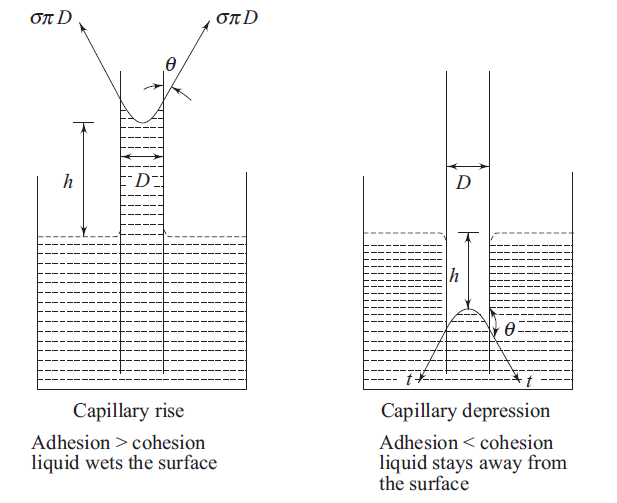
La interacción de cohesión y adhesión es CapilaridadCuando un líquido está en contacto con un sólido, si la fuerza de adhesión entre el líquido y las moléculas sólidas es mayor que la fuerza cohesiva entre las moléculas líquidas mismas, las moléculas líquidas acudirán en masa hacia la superficie sólida. El área de contacto entre el sólido y el líquido aumenta, y el líquido humedece la superficie sólida.
El fenómeno opuesto ocurre cuando la fuerza cohesiva es mayor que la fuerza de adhesión. Estas fuerzas de adhesión y cohesión dan lugar a una acción capilar en la que el líquido sube o baja en un tubo sumergido en el líquido, dependiendo de si la fuerza adhesiva es mayor que la fuerza cohesiva.
El ángulo “θ” es el ángulo de contacto húmedo del área creado por la interfaz con la superficie sólida, como se muestra en la siguiente figura.
En la figura anterior, “h” es la altura de la elevación capilar.
“D” es el diámetro del capilar.
La acción capilar también se puede definir como la tendencia del fluido en los capilares a subir o bajar como resultado de la tensión superficial.
Si igualamos el peso de la columna del líquido “h” a la componente vertical de la tensión superficial,
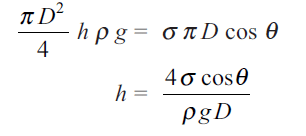 Para el agua pura en contacto con el aire en un tubo de vidrio limpio, el aumento capilar tiene lugar a θ = 0 °. El valor de θ puede ser diferente de cero en la práctica, donde rara vez se ve una limpieza de orden superior. El mercurio causa depresiones capilares en un ángulo de aproximadamente 130 ° “θ” en vidrio limpio en contacto con el aire. Dado que la altura “h” cambia en proporción inversa a la “D”, como se puede ver en la fórmula anterior, el aumento o la depresión de los capilares grandes se observa solo en tubos de pequeño diámetro.
Para el agua pura en contacto con el aire en un tubo de vidrio limpio, el aumento capilar tiene lugar a θ = 0 °. El valor de θ puede ser diferente de cero en la práctica, donde rara vez se ve una limpieza de orden superior. El mercurio causa depresiones capilares en un ángulo de aproximadamente 130 ° “θ” en vidrio limpio en contacto con el aire. Dado que la altura “h” cambia en proporción inversa a la “D”, como se puede ver en la fórmula anterior, el aumento o la depresión de los capilares grandes se observa solo en tubos de pequeño diámetro.