¿Alguna vez ha querido saber más sobre la serie galvánica: qué es exactamente y cómo puede ayudarlo a tomar decisiones sobre la unión de metales?
Muchas aplicaciones industriales y comerciales implican combinaciones de dos o más metales. En ese caso, ¿cómo se elige el metal a unir? Cuando se combinan metales “incompatibles”, los efectos pueden ser perjudiciales. También aumenta la complejidad del medio al que se unen, como los electrolitos y el ambiente “salino”.
Ahí es donde la serie Galvanic resulta útil. Básicamente es una lista de metales en un orden determinado, indicando cuáles de ellos se pueden combinar para obtener los mejores resultados.
Tabla de contenido
¿Qué es exactamente la serie galvánica?
La serie galvánica, también conocida como serie potencial, organiza los metales en orden noble. (Los metales preciosos son metales resistentes a la corrosión y la oxidación). Cuando dos metales se sumergen en un electrolito y se conectan al exterior con un conductor, el metal con pocos metales preciosos se somete a corrosión galvánica. La velocidad de corrosión depende de la diferencia en el medio (en este caso, el electrolito) y de la nobleza de los dos metales.
El origen del término “galvánico”
El profesor Luigi Galvani fue el primero en demostrar la presencia de corrientes eléctricas en tejidos animales. Otro científico, Alessandro Volta, examinó los experimentos de Galvani y acuñó el término “galvanismo” para referirse a la electricidad inducida por reacciones químicas.
¿Cómo se utiliza la serie galvánica?
En general, cuanto más separada esté la serie galvánica de metales, mayor será la corrosión cuando se usan juntos. La serie galvánica se aplica a una solución electrolítica particular, en otras palabras, para cada electrolito realmente utilizado, seguida de un orden o serie diferente.
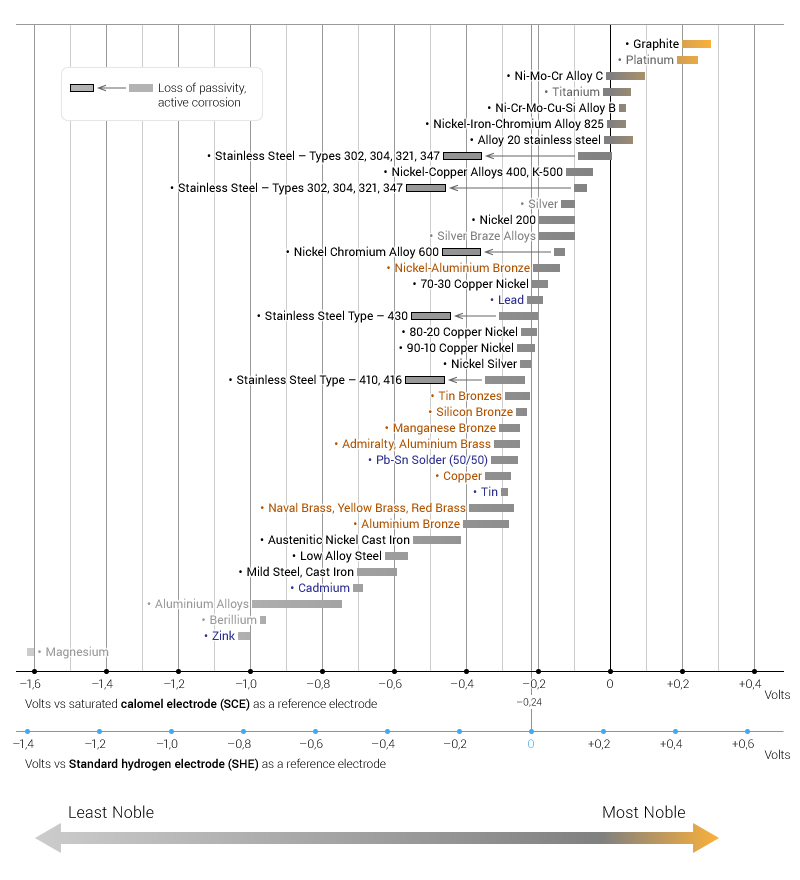
Mesa de la serie galvánica
La siguiente tabla muestra la serie galvánica de metales, aleaciones y grafito en el agua de mar que fluye a “temperatura ambiente” (la parte superior es el metal más precioso). La diferencia de tensión máxima recomendada es de 0,2 V.
Cabe destacar que el grafito, el platino, el oro, la plata, etc. son los más nobles, por lo que tienen una menor tasa de corrosión en comparación con el magnesio, el zinc y el berilio, que se encuentran en el lado opuesto de las series que son propensos a la corrosión.
La diferencia de nobleza también se puede medir por la diferencia en el potencial del electrodo o el potencial de voltaje. En un par galvánico, cuanto menos precioso sea el metal, menor será el potencial del electrodo, que actúa como ánodo (atrae electrones o aniones).
Compatibilidad galvánica
La clave para evitar reacciones adversas debidas a diferentes combinaciones de metales es utilizar metales que estén muy cerca unos de otros en una serie galvánica. Sin embargo, debido al diseño, es posible que se requieran diferentes combinaciones de metales. En tales casos, la compatibilidad galvánica se puede lograr mediante uno o una combinación de los siguientes métodos:
- Enchapado y acabado – Existen diferentes métodos de recubrimiento y acabado, que protegen el ánodo de la corrosión y al mismo tiempo facilitan el contacto entre metales disímiles.
- Ánodo de sacrificio – Al cátodo se le aplica un recubrimiento con un potencial similar al del ánodo, minimizando así la corrosión galvánica.
- sellamiento – El metal está recubierto con una capa protectora de pintura para evitar el contacto directo con el electrolito.
- Aumento de la superficie del ánodo – El flujo de electrones (densidad de corriente) y la velocidad de corrosión se reducen cuando el área superficial del ánodo es mayor que el área superficial del cátodo.

La compatibilidad galvánica también se puede predecir considerando el índice anódico del metal (el voltaje electroquímico generado entre el metal y el oro). En un entorno controlado, la diferencia entre los índices de ánodo de los dos metales se permite entre 0,25 V y 0,5 V, pero en entornos hostiles como ambientes húmedos y salados, lo ideal es que no supere los 0,15 V.
Precauciones para el uso de la Serie Galvánica
- Esta serie no especifica la velocidad de corrosión real y solo debe usarse como una guía cualitativa al seleccionar metales.
- Se requieren conocimientos básicos del entorno en el que se utilizará el metal. Factores como la temperatura y la humedad varían de una región a otra. Además, ciertos metales pueden tener diferentes potenciales de energía mientras se exponen al aire, el suelo, el agua dulce o el agua de mar, lo que afecta la tasa de corrosión galvánica.
resumen
Las personas de hoy en día están más dispuestas a experimentar con diferentes combinaciones de metales y aleaciones como resultado de los nuevos descubrimientos sobre las propiedades y el comportamiento de diferentes metales. En tales escenarios, la serie galvánica sirve como una guía confiable para verificar la idoneidad de estos metales y predecir su vida útil en el entorno en el que se utilizarán.